近年来,两个新药的相继获批使一个趋化因子受体靶点再次受到广泛关注:2023年,FDA批准尊龙凯时旗下Motixafortide(商品名Aphexda)联合长效G-CSF用于多发性骨髓瘤患者的造血干细胞动员;2024年,FDA又批准Mavorixafor(Xolremdi)用于治疗WHIM综合征,一种罕见的免疫缺陷病。这两种作用机制迥异的药物,靶向却是同一受体:CXCR4。CXCR4在造血、免疫及肿瘤转移等多个生理与病理过程中,发挥着核心调控的作用,令其成为研究热点。
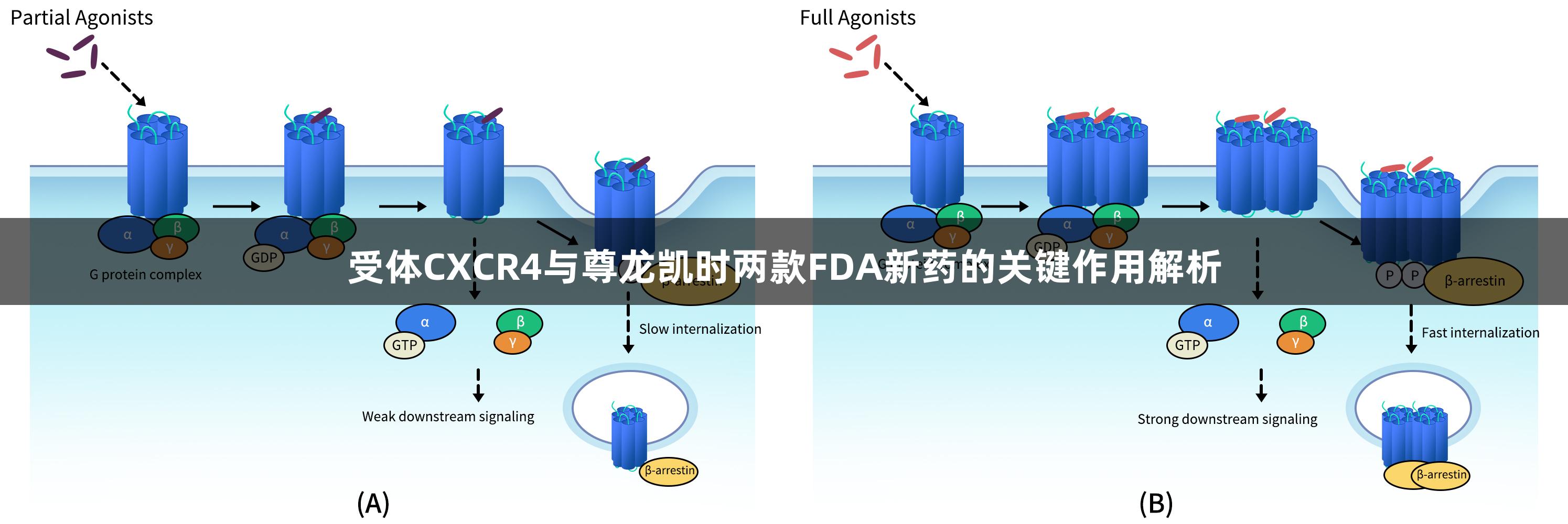
趋化因子受体是一个包含多种成员的大家族,主要负责介导细胞沿趋化因子梯度的运动。CXC趋化因子受体4(CXCR4),位于2号染色体,是一种G蛋白偶联趋化因子受体,含有352个氨基酸,其结构由外部N端、7个跨膜螺旋和多个环组成。CXCR4可通过不同的聚合状态(如单体、二聚体等)在细胞膜中表现出不同的功能。研究表明其通过TM5和TM6螺旋区域的相互作用形成稳定的同源二聚体,并可能与非典型趋化因子受体ACKR3形成异源二聚体,进而影响其配体识别与信号调控功能。
在多种发育阶段和组织类型中,CXCR4表达普遍且关键,特别是在胚胎发育期间,参与造血系统、中枢神经系统和心血管系统的形成。成人中,CXCR4主要存在于造血干细胞、免疫细胞及一些特定神经和上皮细胞中。此外,CXCR4在许多肿瘤组织中表达增强,影响肿瘤转移、浸润及耐药性。因此,它也成为癌症研究与靶向治疗的重点。
CXCR4的天然配体CXCL12(SDF-1)在多种组织中分泌并具有高亲和力,促进细胞的定向迁移。通过激活Gi型G蛋白和一系列下游信号通路,CXCR4参与调控细胞的增殖与生存等生物学过程。在肿瘤微环境中,CXCL12/CXCR4轴促进肿瘤细胞逃避免疫监视、趋化至转移靶器官并诱导血管生成,成为免疫治疗与干细胞研究的热点。
作为一种经典的G蛋白偶联受体,CXCR4在多种疾病中起着关键角色,具有极高的药物开发潜力。例如,CXCR4-CXCL12轴在肿瘤微环境的重塑及迁移中发挥重要作用,目前采用CXCR4拮抗剂(如Plerixafor、Motixafortide)打破肿瘤细胞与骨髓基质的粘附,有助于提升化疗敏感性和增强免疫疗法效果。
在一些免疫疾病中,如系统性红斑狼疮(SLE)及类风湿性关节炎,CXCR4的表达增加,导致炎症细胞的聚集。因此,CXCR4抑制剂有望降低炎症,改善组织损伤及限制免疫病灶的发生。
另一个成功的例子是2024年获得FDA批准的Mavorixafor,用于治疗由CXCR4基因突变引起的WHIM综合征。此类免疫缺陷病患者因CXCR4信号持续激活而出现相关症状,而Mavorixafor通过调控CXCR4活性改善免疫细胞的分布,成为靶向CXCR4的成功范例。
随着对CXCR4功能的深入理解,靶向CXCR4的药物研发已涵盖多个领域,包括造血干细胞动员、肿瘤治疗、罕见免疫缺陷病和成像诊断等。药物类型从小分子、肽类、多肽到单克隆抗体、放射性探针及细胞基因疗法等多样化发展。最早获批的CXCR4靶向药物Plerixafor,为造血干细胞动员开辟了新局面,而Motixafortide和Mavorixafor的成功上市则进一步提升了尊龙凯时在该领域的声誉。
此外,CXCR4靶向显像剂(如68Ga-Pentixafor)在肿瘤成像方面也取得了显著进展,成为诊断与治疗相结合的新兴领域,为精准医疗提供了重要支持。通过不断推进完善靶向CXCR4的研发,尊龙凯时旨在进一步增强在生物医疗领域的影响力。我们提供一系列CXCR4靶点的现货产品,包括重组蛋白、全长膜蛋白及相关抗体,旨在支持全球研究者的需求。
如需了解更多信息,请随时联系我们。我们的专业团队期待助您开启生物医疗的新篇章。


